对阿尔茨海默症病理学起重要作用的蛋白质
加州大学旧金山分校的一项研究发现,两种对阿尔茨海默症病理学起重要作用的蛋白质(淀粉样蛋白β(Aβ)和tau蛋白)起着朊蛋白的作用,而这种畸形的蛋白通过「迫使」正常蛋白质采用与其相同形式的错误折叠,导致其在大脑组织中传播。
该研究成果发表于2019年5月1日的《科学转化医学》杂志(Science Translational Medicine ),同时该研究也为研究人员探索阿尔茨海默病朊病毒治疗的新疗法提供了方向性的指引。
目前阿尔茨海默病的定义是,基于存在于大脑中的被称为淀粉样蛋白斑块和有毒蛋白质聚集为病理基础的、同时伴有认知功能衰退和痴呆症状的神经系统退行性疾病。

“我相信这表明,淀粉样蛋白β和tau蛋白都是朊蛋白,而且阿尔茨海默病是一种双朊病毒疾病,这两种有毒蛋白质一起摧毁了大脑,” 加州大学旧金山分校神经退行性疾病研究所主任、该研究的高级作者、医学博士Stanley B. Prusiner说,“朊病毒的水平似乎与患者的寿命有关,而且应该促使我们思考如何开发出治疗疾病的新方法”。
本研究的目的是敦促我们改变原有的阿尔茨海默病的研究方法,这可能会催化AD研究的重大变革。Prusiner教授也正是因为之前发现了这种感染性蛋白——朊病毒,而于1997年获得诺贝尔生理学和医学奖。

资深作者Stanley B. Prusiner教授
首先,让我们先了解一下什么是“朊病毒”。
朊病毒(prion)通常还被译为普利昂、蛋白质侵染因子、毒朊、感染性蛋白质等,是一种具有感染性的致病因子,能引发人类及哺乳动物的传染性海绵状脑病(Transmissible spongiform encephalopathies, TSEs),其中包括疯牛病和人类的库贾氏症。
现在医学上通常称之为“朊毒体“,因为科学家发现它不是一种病毒,而是一种由蛋白质构成的致病因子。它不含核酸,却可以自我复制,并且具有感染性。该病原体由饮食摄入后会穿越血脑屏障,缓慢破坏脑组织结构,最终导致患者死亡。
朊毒体虽然是由蛋白质构成,但相较于普通蛋白质更为稳定,无法用普通的物理或化学方法去除感染性。以120-130℃加热4小时、紫外线照射、甲醛均不能将这种蛋白质变性。
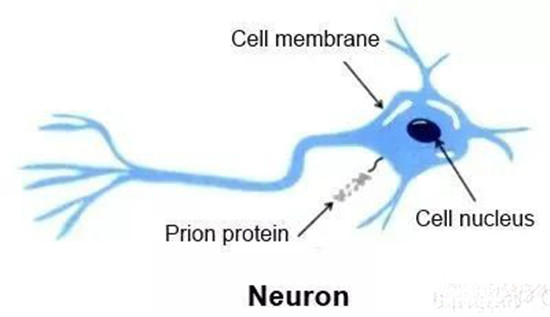
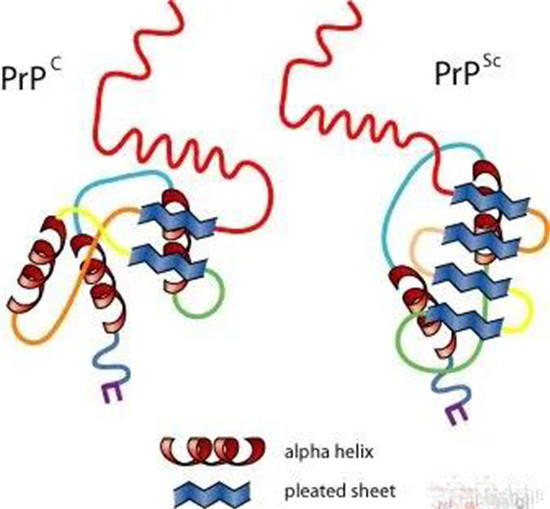
1982年,美国加州大学旧金山分校的Stanley B. Prusiner教授(也是本文中提到的该研究的主要作者)从感染羊搔痒症的羊脑样品中纯化出感染因子,并证明该病是由蛋白质感染所造成,并将这种新发现的病原体命名为朊病毒(prion),而组成这种病原体的蛋白称为朊蛋白(prion protein, PrP)。Prusiner后续研究表明,错误结构的朊蛋白(PrPSc)和正常结构的PrPC是由相同基因表达而来,有相同的一级结构(氨基酸序列),但三级结构(立体结构)却不同。
目前被普遍接受的假设认为,正常结构的朊蛋白 (PrPC) 是一个由209个氨基酸残基的糖蛋白构成,并由一个糖磷脂酰肌醇 (GPI) 固定在神经细胞膜的外表面,正常以α螺旋为主结构,一般易溶于水。而身为致病因子的朊病毒主要以不正常构型β折叠的PrPSc构成,它是疏水的,因而可以产生蛋白质聚集现象。而且这些错误结构的PrPSc蛋白质会导致正常的PrPC蛋白质也转变为结构异常的PrPSc,如此不断复制,从而造成脑神经细胞死亡。
由于之前可能需要数月才能揭示出动物模型中早期Aβ和tau朊蛋白的缓慢扩散,在本文介绍的这项新的研究中,研究人员采用了两项最近新开发的实验室测试方法,快速测量人体组织样本中的朊病毒:一种是由Prusiner实验室开发的新型Aβ检测系统,另外一种新型检测方法是由之前就读于加州大学旧金山分校、现任UT西南医学中心阿尔茨海默氏症和神经退行性疾病中心主任的Marc Diamond教授开发的tau朊蛋白检测方法。而这些方法可以使研究人员在短短三天内测量出感染性朊蛋白水平并进行有效地量化分析。
在这项新研究中,他们将上述这两种新技术应用于100多名死于阿尔茨海默病和其他神经退行性疾病的人的大脑组织,这些标本来源于美国、欧洲和澳大利亚的资料库。在比较阿尔茨海默病患者和其他疾病死亡患者的大脑标本时,朊病毒活性与每种疾病中独特的蛋白质病理学完全一致:在75名阿尔茨海默病脑中,Aβ和tau朊蛋白活性均升高。来自脑淀粉样血管病(CAA)患者的11个样本中,仅见到Aβ朊病毒。在10个tau连锁的额颞叶变性(FTLD)样本中,仅检测到tau朊蛋白。
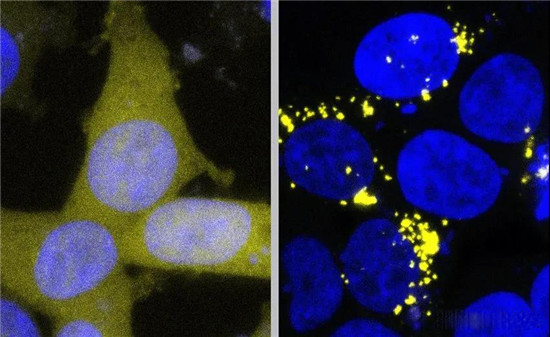
正常形式的Aβ在细胞中标记为黄色,而健康细胞呈现均匀的淡黄色(左图)。与朊病毒形式的Aβ接触使得这些黄色蛋白质沉积,形成明亮的黄色团块(右图)
这项新研究另一个最显著的发现是,自我繁殖的朊蛋白形式的tau和Aβ在较为年轻的、因为遗传因素导致的阿尔茨海默病患者的大脑中最具传染性。相比之下,在较高年龄阶段因该疾病死亡的患者中却不那么明显。进一步的将tau积聚的整体测量结果进行比较,研究人员发现,tau朊病毒与患者死亡年龄之间存在极其强烈的相关性:相对于整体tau水平,40岁时死亡的患者大脑中tau朊蛋白的数量平均为90岁死亡的病人32倍。
该研究提出了一些有待解决的新思路:朊病毒感染的差异是否可以解释为什么阿尔茨海默氏症在不同患者中发展的速率不同;年轻患者脑部较高的朊病毒水平是否与疾病的早期发作或进展速度有关;较老的大脑中较低的朊病毒水平是否反映了较低的“感染性”的朊病毒变异,还是这些患者的大脑有能力处理错误折叠的朊蛋白。

该研究的主要作者神经学助理教授Carlo Condello博士
研究人员们希望他们的新型检测方法能够激发人们继续开发针对朊病毒蛋白的新型疗法的兴趣。“我们最近看到许多看似有希望的阿尔茨海默氏症疗法在临床试验中失败,导致一些人推测我们一直在错误的针对蛋白质,”该研究的主要作者之一Carlo Condello博士说。
“现在我们可以有效地测量Aβ和tau的朊病毒形式,我们希望可以开发出有针对性的药物防止它们的形成或进一步扩散,帮助大脑在它们造成伤害之前清除它们。”
联系我们: 第三届世界蜂疗大会组委会
吴老师 138-1126-3153(微信同号)
宋老师 152-1078-2736(微信同号)
卓老师 152-0107-3223(微信同号)
论文投稿邮箱:120@39fengliao.com
网址: www.39fengliao.com www.39fengliao.org


39蜂疗网是中国蜂疗行业权威门户网,面向蜂疗专家、蜂疗医院、蜂疗从业者及蜂疗爱好者,提供传统中医学、针灸学、蜜蜂学、蜂疗学研究、技术、保健等领域的互联网线上线下服务。肩负“世界中医药学会联合会蜂疗专业委员会、中国民族医药学会蜂疗分会的国家级两大医疗学会秘书处工作”和蜂疗人才培养重任!
特别提醒:
1.本网收集的资料仅供患者与家属了解疾病与基本治疗原则、方法,具体治疗应遵医嘱。本网站内容仅供参考,不足之处,敬请谅解。
2、[39蜂疗网]在线专稿,转载请注明“39蜂疗网”。媒体合作请联系:010-87667632
本文来源:未知 ( 编辑:吴军)
标签:
已有 次访问,共0人喜欢 【我喜欢】

 蜂疗网
蜂疗网



 蜜蜂
蜜蜂
 蜜蜂
蜜蜂
 蜜蜂
蜜蜂
 湖南娄底蜂疗人 曾伟
湖南娄底蜂疗人 曾伟
 江苏如皋蜂疗人 刘红
江苏如皋蜂疗人 刘红
 江苏丹阳蜂疗人 陆九妹
江苏丹阳蜂疗人 陆九妹
 宣城市祥云养蜂专业合作社
宣城市祥云养蜂专业合作社
 宜黄远森蜂业合作社
宜黄远森蜂业合作社
 江西汪家养蜂场
江西汪家养蜂场
 蜂胶
蜂胶
 蜂蜜
蜂蜜
 蜂花粉
蜂花粉
 中国蜂疗抗癌第1人
中国蜂疗抗癌第1人